Introducción
Una de las funciones del Centro Estatal de Medicina Transfusional del Estado de Guanajuato (CEMTGTO), es actuar como Laboratorio Estatal en el estudio de problemas inmunohematológicos.
Los casos de aglutinaciones inespecíficas, aquellos que no manifiestan una clara especificidad en la imagen obtenida de un panel de células de fenotipo conocido, así como los casos de panaglutinación, aquellos debido a anticuerpos capaces de aglutinar a todos los hematíes reactivos (panel), son particularmente difíciles de resolver, algunos de ellos no tienen un resultado concluyente, sin embargo, las necesidades de transfusión de un paciente en particular, nos obligan a agotar todas las herramientas inmunohematológicas disponibles en nuestro centro de trabajo, siendo demandantes de especialización y pericia de personal multidisciplinario.
El problema se complica cuando, además del riesgo de inmunización a aloanticuerpos por transfusión o embarazo, existe autoinmunidad propia de algunos padecimientos.
Son de especial atención aquellos pacientes que, por su padecimiento, dependen de múltiples y continuas transfusiones. El Síndrome Mielodisplásico (SMD) pertenece a este grupo de patologías puesto que reciben con frecuencia transfusiones de Concentrados Eritrocitarios (CE) debido a la anemia resultante de una eritropoyesis ineficaz. En este grupo en particular, se han reportado tasas de incidencia de inmunización del 15%, entre aloanticuerpos, autoanticuerpos y mezclas de aloanticuerpos + autoanticuerpos independiente del sexo, edad y la categoría de SMD. La tasa de incidencia de aloinmunización aumentó hasta el 19.5% después de 130 unidades de glóbulos rojos. Las especificidades más comunes fueron anti-K1, anti-E, anti-c y anti-Jka. En la mayoría de los pacientes aloinmunizados, solo estaban involucrados los sistemas Rh y Kell1.
Material y Métodos
Se realizó una compilación retrospectiva de los reportes generados en la fase post analítica de nuestra Institución, obtenidos del software de gestión de sangre.
El desarrollo se llevó a cabo por personal Químico y Técnico de todos los turnos, a quienes corresponde y se reconoce el mérito.
Objetivo
Describir el seguimiento inmunohematologico de un paciente politransfundido, así como los retos que significa obtener sangre compatible en este tipo de casos.
Resumen Clínico
Masculino 74 años, con diagnóstico de Síndrome Mielodisplásico tipo 5q menos (3 años de evolución), con tratamiento de Eritropoyetina, Danazol y Talidomida, presenta requerimientos transfusionales frecuentes, cuenta con antecedentes de múltiples ingresos hospitalarios por esta causa, cuadros infecciosos recurrentes (neumónicos y de infección en piel), se le diagnóstica con Melanoma Acral Lentiginoso con 20 años de evolución, tratamiento quirúrgico de resección de áreas de piel con recaída, no recibió Quimioterapia. Fecha de defunción: 5 /julio/ 2019
Causa de defunción: falla multiorgánica/choque séptico
Desarrollo del Caso
El Servicio de transfusión remitente manifiesta tener conocimiento del paciente desde diciembre de 2015, debido al padecimiento, el paciente fue multitransfundido y referido a CEMTGTO (01/julio /2016 hasta el último evento en 02/julio/2019) por presentar incompatibilidad a concentrados eritrocitarios.
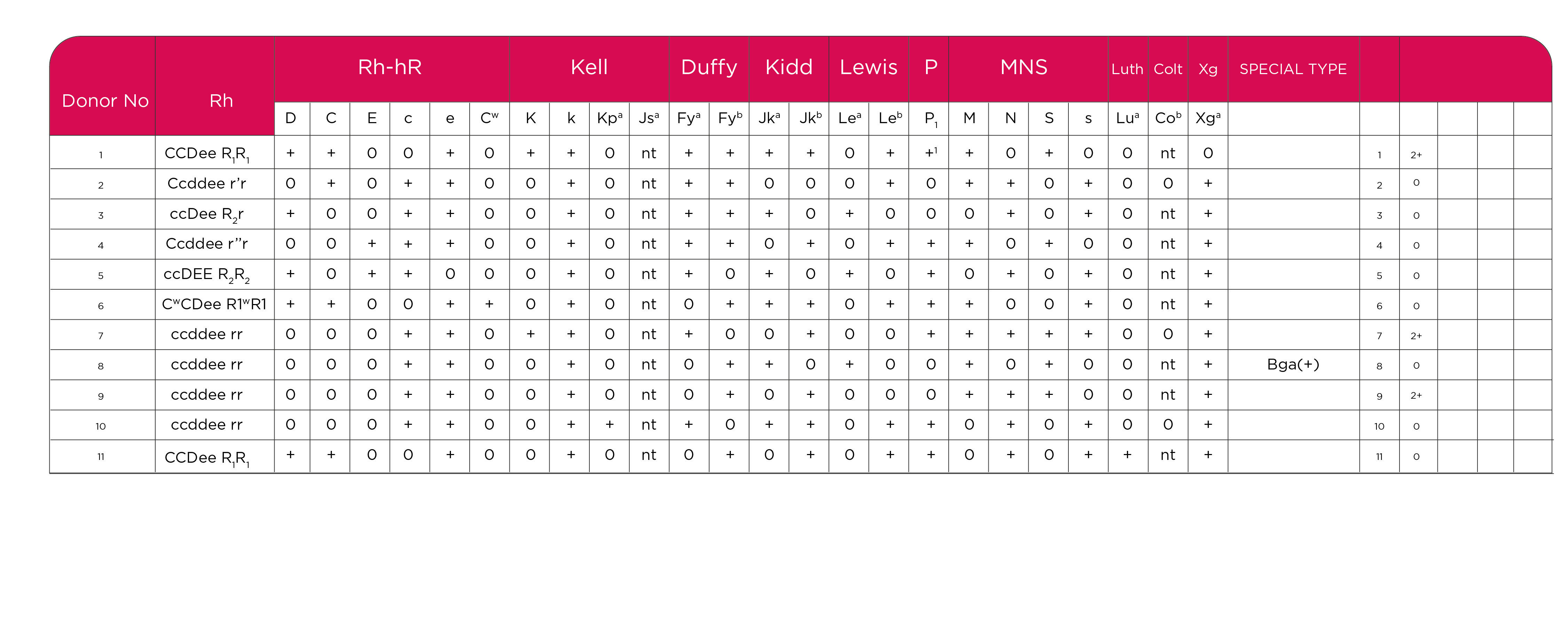
El paciente se recibió en 33 episodios, en los cuales se estudiaron 104 unidades de CE. Según reportes de egresos, se administraron 86 unidades remitidas por nuestra institución, desconociendo la totalidad de transfusiones realizadas, se realizaron 9 veces Rastreo de Anticuerpos Irregulares (RAI), 4 veces caracterización de Coombs Directo Poliespecifico, 6 veces caracterización de Coombs Directo con AGH monoespecifica en donde se determina Anti IgG monoespecífico y Anti C3d monoespecífico y en 18 ocasiones se realizó Identificación de Anticuerpos Irregulares (IAD). Tabla 1.
Tabla 1. Resumen de los datos relevantes de algunos de los episodios
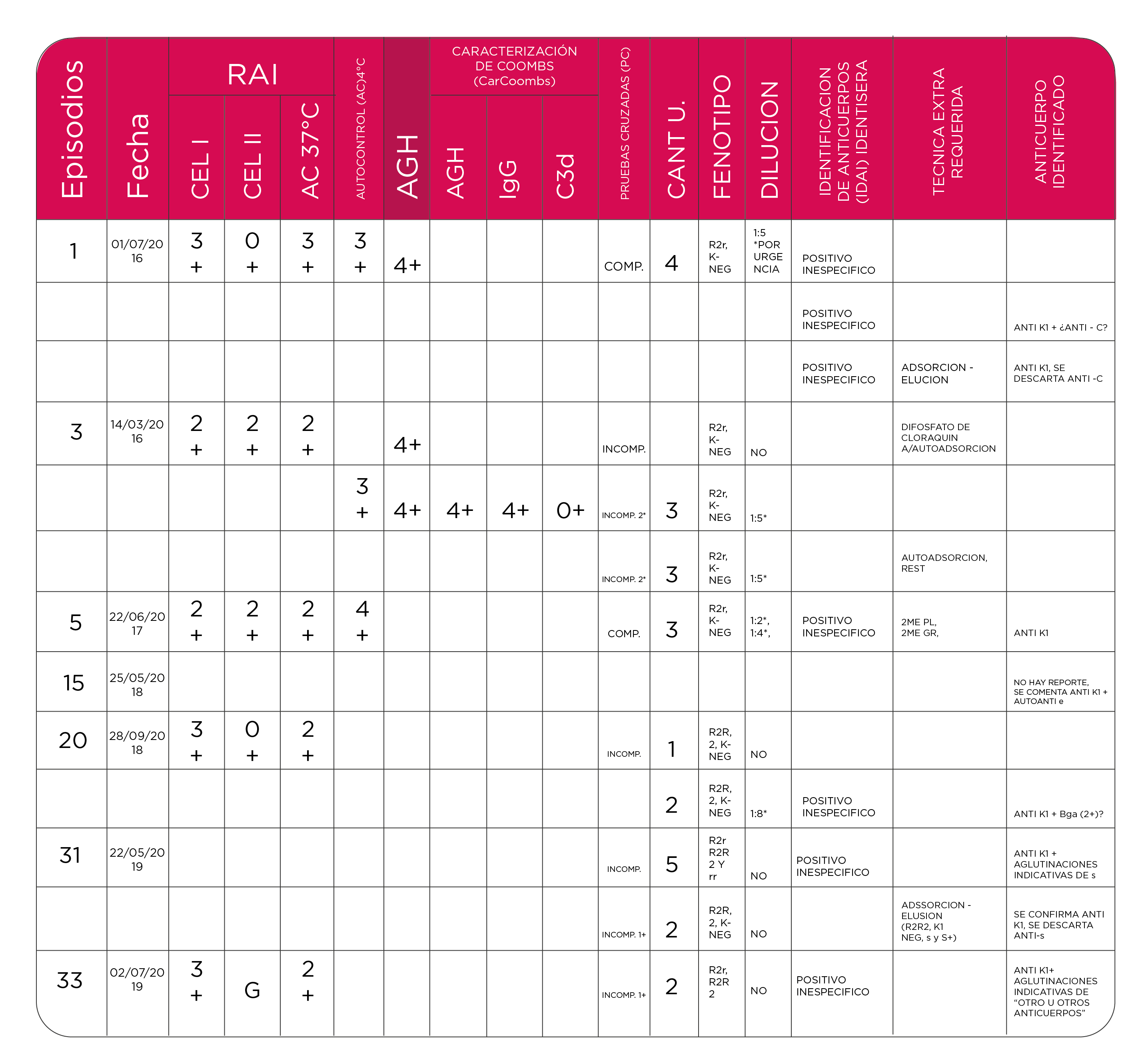
Durante el primer episodio se realizan pruebas básicas de inmunohematología, Grupo ABO y Rh; “O” Positivo, Fenotipo Sistema Rh, ccDEe (R2r) con los siguientes hallazgos serológicos:
RAI: POSITIVO, Cel I 3+, Cel II Neg, Ac 3+
AC 4°C: 3+, AGH: 4+
PC plasma basal: incompatible
IAD: positivo con aglutinaciones inespecificas
PC plasma con dilución 1:5: compatible.
Rastreo de Anticuerpos Irregulares (RAI): Positivo. Se utilizó un kit comercial compuesto de dos viales de células, desarrolladas en la técnica de DG-Gel, LISS-Coombs a 37°C, conteniendo AGH, técnica con alta sensibilidad, pero con la caracteristica que no permite observar la amplitud térmica del anticuerpo.
Autocontrol a 4°C. (AC4°C): Positivo. En nuestra Institución se complementa con un autocontrol a 4°C en la tarjeta de DG-Gel neutra.
Identificación de Anticuerpos Irregulares (IDAI): Positivo sin mostrar especificidad clara. Esto debido a la concomitancia de dos o más especificidades, la posibilidad de que se presente un anticuerpo contra antígenos de alta o baja frecuencia y/o la concomitancia de autoanticuerpos.
Dados los resultados obtenidos se vislumbra una investigación más extensa y debido a la necesidad de transfundir al paciente se optó por la técnica auxiliar más rápida, dilución del suero o plasma del paciente en una proporción 1:52, técnica de laboratorio que ha demostrado disminuir la actividad de los autoanticuerpos para evidenciar la posible presencia de aloanticuerpos bajo el razonamiento que los autoanticuerpos están constantemente siendo adsorbido por los glóbulos rojos del paciente y no así los aloanticuerpos. Es importante mencionar que la dilución del suero no es una técnica recomendable debido a que existe la posibilidad de perder algún aloanticuerpo, sin embargo ante la gravedad de este caso se consideró realizarla. Se encontraron 4 unidades “0” Positivo R2r compatibles.
Continuando con la investigación y considerando la alta sensibilidad de la tecnología en gel, a fin de eliminar interferencias como fibrina, leucocitos o bacterias sobrenadantes en el plasma, se toman como medida preanalítica adicional, filtrar el plasma con filtro de jeringa 0.22 µm. En nuestra institución hemos observado la disminución de interferencias, sobre todo cuando no se tiene un control sobre el proceso de centrifugado recomendado para obtener un plasma acelular, centrifugar 2000 a 3000 x g 15´3 .
Un resultado positivo de AC a 4°C, evidencia la presencia de Autoanticuerpos fríos, los más frecuentes serían anti-I, anti-H ó anti-IH, normalmente insignificantes clínicamente, pero que en algunos padecimientos pueden exacerbarse hasta hacerse detectables a temperatura ambiente y con ello interferir en las determinaciones de rutina en la fase de Coombs.
Ante la presencia de autoanticuerpos la técnica más recomendable para eliminar la interferencia sería la autoadsorción, esto requiere; a) suficiente muestra de glóbulos rojos autólogos, con el requisito que el paciente no haya sido transfundido dentro los 120 días previos. b) lavados con solución salina fisiológica amortiguada a 37°C. o bien de ser posible c) el tratamiento previo a los glóbulos rojos autólogos con enzimas.
Una alternativa a este largo proceso es la adsorción con estroma de conejo. Existen evidencias que los glóbulos rojos de conejo poseen antígenos I, H y HI4, nuestra institución cuenta con un kit comercial al respecto.
Así pues, al plasma “filtrado previamente”, se le realizó adsorción con estroma de conejo. Con el plasma adsorto se procedió a realizar IAI, resultando una sugerente de mezcla compuesta por probable Anti-K1 más otro anticuerpo sin especificidad que probablemente sea un Anti-C. Ante esta probable mezcla de anticuerpos se decide utilizar la combinación de las técnicas de adsorción y elución, para esta ultima en nuestra institución utilizamos un kit comercial de elución ácida.
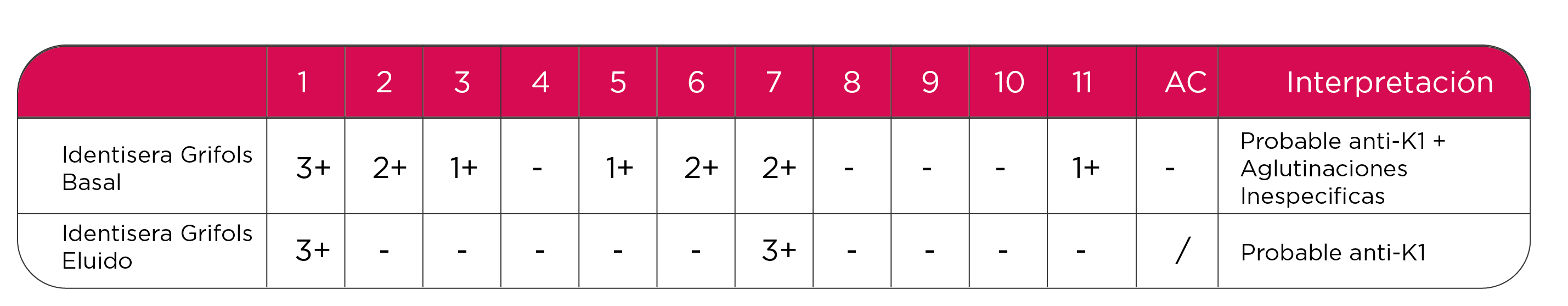
Para la realización de estas técnicas se seleccionaron células positivas al Ag K1, principal objetivo, aunque por la disponibilidad del mismo, también contenían el Ag. C. El resultado de IAI con el eluato, manifestó claramente el Probable Anti-K1, sin interferencias, por lo cual se descarta la presencia de Anti-C y de ahí en adelante se eligieron unidades isogrupo e isofenotipo “O” Positivo, R2r, K1 negativo. Tabla 2.
Tabla 2. Resultados de adsorción y elusión
En el Episodio 3, se observan los siguientes resultados:
RAI*: POSITIVO, Cel I 2+, Cel II 2+, AC 2+
AGH*: 4+
AC 4°C: 3+
Coombs monoespecifico; Anti IgG 4+, Anti C3d
NEG, Ctl NEG.
PC plasma basal: INCOMPATIBLES
PC plasma diluido 1:5 INCOMPATIBLES.
*Referido por el Servicio de Transfusión.
Se recibió muestra que cumplía con las características de tiempo para poder realizar la técnica de autoadsorción (> 3meses posteriores a la última transfusión). Se realizó autoadsorción a 37°C, previamente se trató con difosfato de cloroquina a los globulos rojos autólogos para disociar la IgG de la membrana eritrocitaria sin afectar su integridad6.
En este episodio no se logró la compatibilidad a pesar de realizar una segunda autoadsorción, adsorción con estroma de conejo e incluso dilución del plasma 1:5.
En el Episodio 4, continúa manifestándose el Probable Anti K1 en plasma diluido 1:5.
En el Episodio 5 se obtienen los siguientes resultados:
RAI: POSITIVO Cel I 2+, Cel II 2+, AC 2+, Coombs directo: 4+.
De acuerdo con el comportamiento serológico previo (autoanticuerpos IgM como IgG), se decide tratar tanto glóbulos rojos autólogos como al plasma con 2 Mercaptoetanol 0.1 M (2ME)7 para destruir los autoanticuerpos IgM, por lo que se pueden utilizar para la identificación de anticuerpos en una mezcla de anticuerpos IgM e IgG, particularmente cuando un anticuerpo IgM aglutinante enmascara la presencia de IgG concomitante.
Posterior al tratamiento con 2ME se observó disminución de aglutinación en Cel. I del RAI obteniendo los siguientes resultados:
RAI: POSITIVO, Cel I 1+, Cel II 2+, AC 2+, AC 4°C: NEGATIVO.
La dilución 1:5 no siempre fue lo suficientemente útil para discernir sobre la presencia de algún aloanticuerpo (además del Anti K1 ya conocido) ya sea por temor a diluir demasiado y perder probables aloanticuerpos de nueva formación o bien porque era demasiado baja para disminuir la actividad de los autoanticuerpos, así que, optamos por titular el plasma frente a un “pool” de glóbulos rojos reactivo (células marcadas como “Semipanel” en la carta antigénica del Panel producido por Banco de Sangre C.M.N. Siglo XXI) hasta obtener una aglutinación de 1+8 a la cual denominamos “Dilución óptima”.
En esta ocasión se realizó una dilución 1:4, teniedo como resultados: PC compatibles y en la IAI se ratifica la presencia Anti K1.
En episodios posteriores se llegó a obtener como dilución óptima 1:16, Tabla 3. En donde se sigue manifestando la presencia del Anti-K1, Tabla 4.
Tabla 3. Resultados obtenidos en siguientes episodios
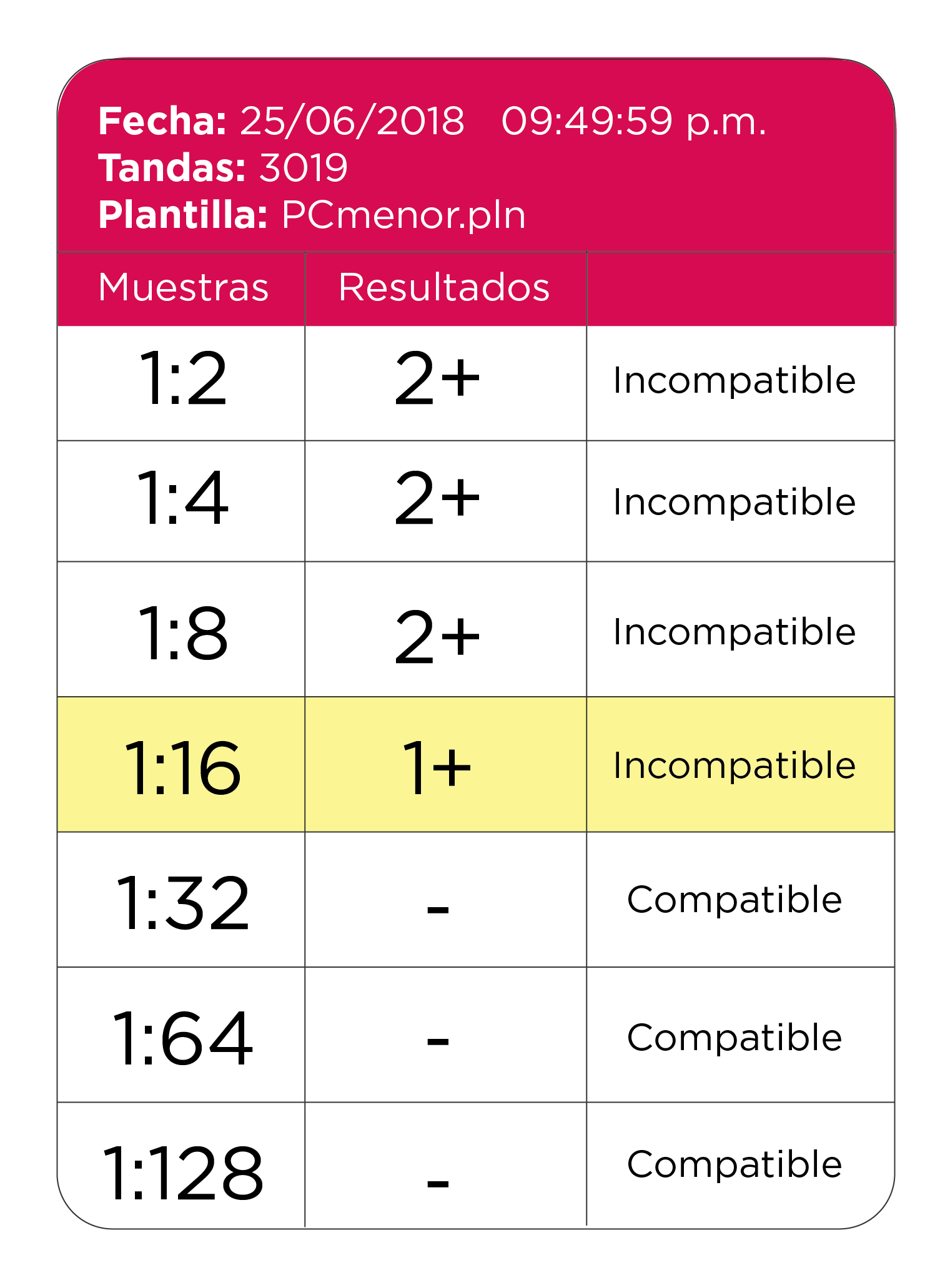
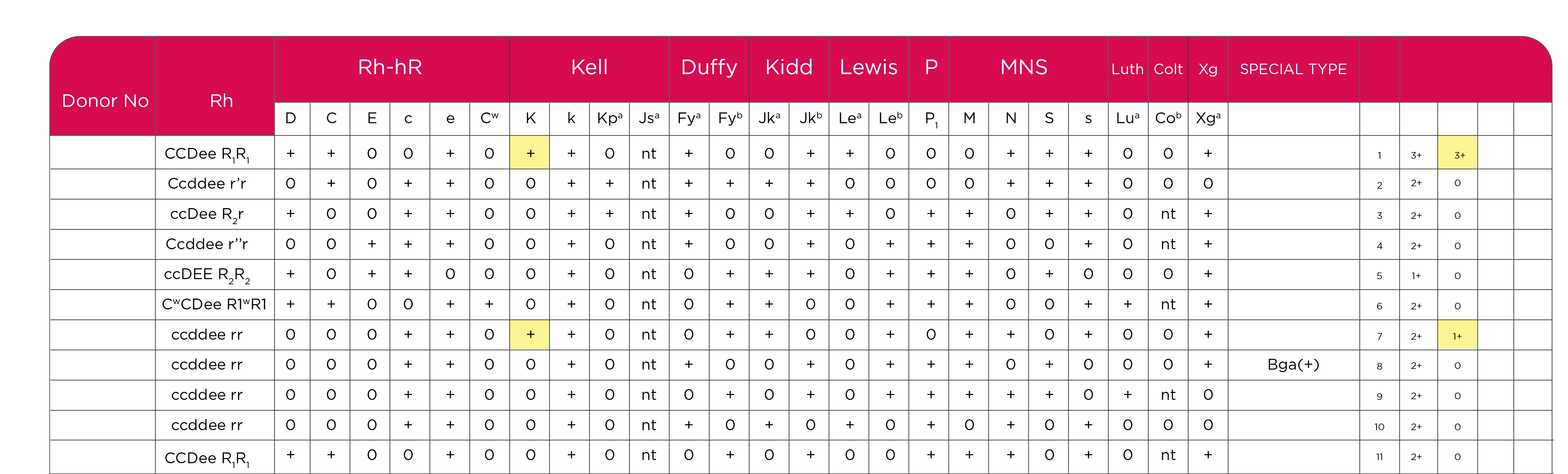
Tabla 4. Carta antigénica (carta panel) Identisera Diana, Grifols.
Episodio No. 15. Se manifestaron aglutinaciones sugerentes de una mezcla compuesta por Anti-K1 y Anti-Fya, por lo cual se realizó la técnica adsorción-elución con células Fya +, el plasma adsorto manifestó especificidad del anticuerpo “Anti-e”, pero, con actividad como autoanticuerpo pues el paciente presenta el antígeno, el resultado del eluato fue negativo, por lo cual se descartó la presencia del Anti- Fya. En episodios posteriores se prefirió suministrar unidades de CE R2R2, K1 Negativo. Tabla 5.
Tabla 1. Resumen del caso detectado de evanescencia de anti-E

Para el Episodio 20, se obtienen los siguientes resultados:
RAI*: POSITIVO Cel I 3+, Cel II Negativo, AC 2+
PC plasma basal: INCOMPATIBLE
PC plasma diluido 1:8 INCOMPATIBLES.
En este episodio el resultado de IAI, empleando plasma diluido 1:8, manifestó Anti K1 y aglutinaciones en una célula poseedora del Ag. Bga. Tabla 6 .
Tabla 6. Carta antigénica (carta panel) Identisera Diana, Grifols.
Los Antígenos Bga (Bennett-Goodspeed), no pertenecen a ningún Sistema de Grupo Sanguíneo. Las moléculas HLA de clase I se expresan en la mayoría de las células somáticas, variando el nivel de expresión en diferentes tejidos; así mismo, se expresan en las células nucleadas de la sangre, incluyendo linfocitos T, B, granulocitos, las plaquetas y en algunos casos, los hematíes expresan débilmente moléculas HLA de clase I, Algunas cartas de panel eritrocitario manifiestan en una columna “tipos especiales” las excepciones cuando todos los eritrocitos son positivos o negativos a algún antígeno en particular, tal es el caso del Antígeno Bga.
En episodio 31, el resultado de IAI, manifiesta además de Anti-K1, imagen sugestiva de Anti-s, por lo cual se realizan técnicas de adsorción/elución utilizando células R2R2, K1 negativo, S y s positivos. En el plasma adsorto, se confirma la presencia de Anti-K1, y en el eluato no se demostró la presencia de Anti-s.
Por último episodio, número 33, el resultado de IAI, se obtiene una vez más el Anti K1 más anticuerpo (s) inespecífico con aglutinación de 1+.
Discusión
La revisión del presente caso clínico nos ha llevado a reflexionar sobre la gama de técnicas de laboratorio de inmunohematología que debemos de tener establecidas y documentadas.
Los pacientes referidos por presentar “incompatibilidad”, es decir que ya han producido anticuerpos debido a transfusión o embarazo, denominados “respondedores” o bien, aquellos que presentan alguna enfermedad autoinmune o ambas situaciones, representan un reto para el banco de sangre y a la vez, la responsabilidad de seleccionar el CE más adecuado, que es aquel que no contiene el antígeno ó antígenos contra los anticuerpos desarrollados. Así pues, la tarea inicial y fundamental sería identificar los anticuerpos implicados en un caso.
Es Indispensable conocer el comportamiento serológico de los anticuerpos clínicamente significativos, el comportamiento de los autoanticuerpos que con mucha frecuencia se comportan como panaglutininas tanto en el plasma como en el eluído obtenido de los glóbulos rojos autólogos, algunas ocasiones adquieren comportamiento con “especificidad relativa” principalmente a antígenos del sistema Rh e incluso comportamiento similar a aloanticuerpos.
Este paciente manifestó en un inicio comportamiento similar a un probable “Anti-C”, el paciente “propositus” (fenotipo cDEe (R2r)) no posee el antígeno C, por lo consiguiente, si se manifiesta especificidad Anti-C, ésta debería ser como aloanticuerpo. De la misma manera se reportó “especificidad relativa” del autoanticuerpo como Anti-e. No es extraño el comportamiento de los autoanticuerpos con especificidad al Sistema Rh, muchos reaccionan con todos los glóbulos rojos excepto, con los glóbulos rojos Rh Nulo y algunos refieren especificidad relativa principalmente al Anti-e, de la misma manera se refiere la relación entre la presencia de aloanticuerpos y mayor prevalencia de autoanticuerpos en el paciente.
Respecto al método de dilución del plasma utilizado para detectar aloanticuerpos en presencia de autoanticuerpos, aunque es conveniente, no fue la opción más adecuada, ya que se ha reportado falta de sensibilidad al no ser capaz de detectar hasta el 27% de aloanticuerpos clínicamente significativos comparado con métodos de adsorción autóloga o heteróloga (según la historia transfusional del paciente) empleando reactivos como Polietilenglicol (PEG) o incluso la adsorción heteróloga con GR tratados con ZZAP , sin embargo, en su momento fué la técnica con la que se contó en ese momento. En la actualidad, utilizamos adsorción autóloga o heteróloga, según el caso, utilizando PEG como potenciador con mejores resultados.
En estos casos, requerimos de una buena selección de células heterólogas, lo cual implica fenotipar “in extenso” células R1R1, R2R2 y rr a los antígenos que más frecuentemente se adquieren de los sistemas sanguíneos que han mostrado ser clínicamente significativos como Kell, Duffy, Kidd, MNSs, P, Lewis y en nuestra población, el sistema Diego. Esto implica estudiar varias células en cada evento, lo cual genera retraso y gasto de insumos. En un futuro, una alternativa a esta problemática es el uso de estroma de glóbulos rojos humanos que cumplan con las características necesarias, material biológico que puede mantenerse congelado y tener la disposición al momento que se requiera.
Otro factor determinante en la pronta resolución de estos casos es el tiempo de incubación necesario en la reacción antígeno-anticuerpo, convencionalmente utilizando temperatura húmeda en “baño maría “de una hora, empleando potenciadores y técnicas en gel se reduce a 15 minutos, pero lo prometedor, también esperando el futuro sería la incubación a 37°C por láser infrarrojo (980 nm) reduciendo el tiempo en hasta apenas 5 min .
Respecto a la selección de fenotipo, en todo momento se respetó la compatibilidad ABO, a fenotipo Rh y al Ag K1, en su momento también se consideró la especificidad relativa mostrada por el autoanticuerpo.
En varios episodios se detectaron aglutinaciones inespecíficas, tal vez producto de los anticuerpos anti-HLA, que tan frecuentemente encontramos en sueros de gestantes o de algunos pacientes politransfundidos, que pueden interferir en ocasiones con la identificación de anticuerpos irregulares al reaccionar con algunos hematíes-reactivos, células de escrutinio o células de los paneles de identificación .
No se tuvo reporte sobre alguna reacción transfusional a lo largo del acompañamiento.
Conclusión
Es importante al abordar las pruebas pretransfusionales, siempre extremar factores preanalíticos (centrifugado, lavado de células, revisión de solicitud e historia clínica del paciente, etc.) perseguir cada vez la mejora de los factores analíticos y no dar por finalizado el proceso sin un adecuado proceso postanalitico (reporte de hallazgos, hemovigilancia, etc.), lo cual nos involucra a todo el equipo multidisciplinario que conforma un banco de sangre.
- Red blood cell alloimmunization in transfused patients with myelodysplastic syndrome or chronic myelomonocytic leukemia Sanz, C., Nomdedeu, M., Belkaid, M., Martinez, I., Nomdedeu, B., &Pereira, A. (2013).Transfusion,53(4), 710–715. https://doi.org/10.1111/j.1537-2995.2012.03819.x
- Evaluation of methods for detecting alloantibodies underlying warm autoantibodies. Regina M. Leger MT(ASCP)SBB, George Garratty PhD, FRCPath. 2002.Transfusion,39(1), 15-16. HTTPS://DOI.ORG/10.1046/J.1537-2995.1999.39199116889.X
- Obtención de muestras sanguíneas de calidad analítica: mejoría continua de la etapa preanalítica. - Luis Moran Villatoro. - Editorial Médica Panamericana S.A.- 2001.-México.-AMBC.
- Blood Group Antigens I, i, H and HI on Monkey, Rabbit and Guinea Pig Erythrocytes. S. Kathryn Zelenski and Reginald M. LambertView all authors and affiliations. Volume 145, Issue 2
https://doi.org/10.3181/00379727-145-37856
-
Edwards, J. M., Moulds, J. J., & Judd, W. J. (1982). Chloroquine dissociation of antigen-antibody complexes. A new technique for typing red blood cells with a positive direct antiglobulin test. Transfusion, 22(1), 59–61.
https://doi.org/10.1046/j.1537-2995.1982.22182154219.x
- Métodos 2.18 y 3.8 Manual técnico: traducción al español de la 17ª edición de la American Asocciation of Blood Banks 17ª ed. Buenos Aires : Asociación Argentina de Hemoterapia e Inmunohematología, 2012.
- Garratty G. What do you do when all units are incompatible?. Rev Med Inst Mex Seguro Soc. 2005;43 (Suplemento: 1):107-111.
- Importancia-HLA-en-transfusion.-CCanals.-Enero-2022. GCIAMT.
- Autoantibodies induced by blood transfusión. George Garratty PhD, FRCPath.Transfusion, 44 (1), 2004. https://doi.org/10.1111/j.0041-1132.2004.00658.x
- Branch, D. R., & Petz, L. D. (1982). A new reagent (ZZAP) having multiple applications in immunohematology. American journal of clinical pathology, 78(2), 161–167. https://doi.org/10.1093/ajcp/78.2.161.
- Wilson, E. M., & Branch, D. R. (2019). Human red blood cell stroma: an alternative to traditional allogeneic adsorption methods. Transfusion, 59(12), 3736–3745. https://doi.org/10.1111/trf.15585
- Laser incubation for the rapid detection of red cell alloantibodies in human blood samples (2022).Clare A. Manderson, Heather McLiesh, Joanne Tanner, Diana Alves, Jim Manolios, Gil Garnier. Vox Sanguinis., 117(11), 1302-1309.
- Muñiz-Díaz E. La transfusión de hematíes de fenotipo idéntico: ¿a quién y cuándo? Rev Mex Med Transfus. 2022; 14 (s1): s85-s91. https://dx.doi.org/10.35366/107033
- Brown, CJ y Navarrete, CV (2011), Relevancia clínica del sistema HLA en la transfusión sanguínea. Vox Sanguinis, 101: 93-105. https://doi.org/10.1111/j.1423-0410.2011.01474.x