Inmunotipificación
Apostar por una Técnica Sensible, Rápida y Totalmente Automatizada
Jefe médico de Laboratorio Core de Asociación Española, Montevideo, Uruguay. Profesora Adjunta del Departamento de Laboratorio Clínico,
Bioquímica, Hospital de Clínicas, UdelaR.
Introducción
Las Gammapatías Monoclonales (GM) se definen por la expansión clonal de células plasmáticas, lo que resulta en la excreción característica de una o más inmunoglobulinas monoclonales (Proteína Monoclonal); su presencia puede ser en suero u orina, en forma de inmunoglobulina intacta, fragmentos y/o cadenas livianas libres, abarcando un amplio espectro de trastornos clínicos, desde la presentación asintomática, Gammapatía Monoclonal de Significado Incierto (MGUS), hasta aquellas con gran mortalidad, como Mieloma Múltiple (MM) y Amiloidosis (AL).
La detección y cuantificación de la proteína monoclonal es realizada usualmente desde el Proteinograma Electroforético (PEF) en suero, confirmándose su naturaleza monoclonal, por medio de la técnica de Inmunofijación (IF) o Inmunotipificación (IT) 1,2.
La inmunofijación se ha considerado la técnica de referencia para la identificación de la proteína monoclonal; con el paso del tiempo la innovación ha impuesto la inmunotipificación por electroforesis capilar como una alternativa.
La inmunotipificación se ha incluido en guías internacionales de armonización para detección y cuantificación de proteínas monoclonales, como son las publicaciones realizadas recientemente en el año 2021 por el Colegio Americano de Patólogos (CAP), así como las guías Canadienses (Canadian Society of Clinical Chemists) y las guías de Australia-Nueva Zelanda (Working Party on Standardised Reporting of Protein Electrophoresis) 3,4,5. Considerándola como parte arsenal del diagnóstico y del seguimiento de las GM. Aun así, el International Myeloma Working Group (IMWG) incluye solo a la inmunofijación como técnica para evaluar la respuesta terapéutica del paciente; siendo un deber en las mismas incluir la IT 6.
Fundamentos técnicos:
Se realiza por técnica de Electroforesis Capilar de Zona (EC); para ser más específicos en una electroforesis en solución libre, que logra separar en 6 fracciones proteicas, caracterizada por ser sencilla, versátil y veloz. Se realiza en capilares hechos de sílice fundido, los cuales por su constitución determinan el característico Flujo Electroendosmótico (FEO), siendo el movimiento resultante preferencial sobre el movimiento de partículas. El capilar se llena con el tampón alcalino, la muestra es aspirada por presión negativa en el extremo anódico, aplicando un campo eléctrico continuo (inyección electrocinética), siendo detectadas las proteínas por el extremo catódico, por absorbancia (200 nm), prescindiendo de la coloración como medida de lectura interpretativa. Los capilares por su constitución logran disipar el calor, logrando alcanzar rápidamente altas temperaturas, evitando el efecto Joule, observado en la inmunofijación.
La inmunotipificación es la técnica alternativa a la inmunofijación, siendo más automatizada, permitiendo carga continúa de muestras, identificación por código de barras, modo de dilución automático elegible de acuerdo a la cuantía de las inmunoglobulinas involucradas, evitando una sustracción incompleta.
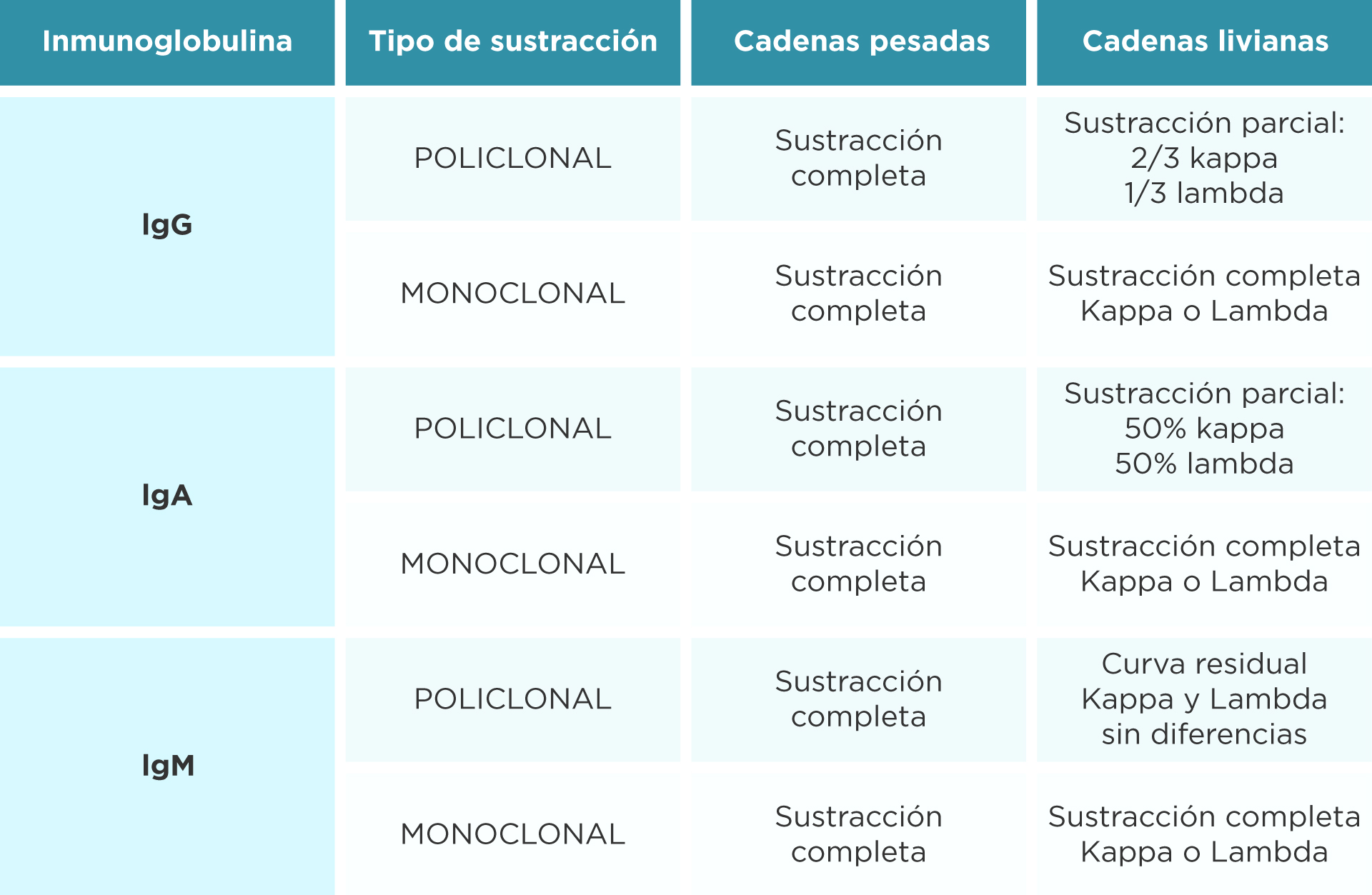
Se emplean antisueros monoespecíficos, anticadenas pesadas (IgG, IgA e IgM;) y anticadenas livianas (Kappa y Lambda).
Etapas analíticas de la Inmunotipificación (IT):
Se inicia con la dilución del suero con un diluyente específico, esto se adapta a la concentración de las Inmunoglobulinas de la muestra.
Se realiza una mezcla posterior con los antisueros, en pocillos separados, con la formación de los complejos antígeno-anticuerpo.
Inyección de las muestras con la realización de la migración electroforética.
Se superponen los perfiles de los antisueros que permitirán la caracterización de la proteína monoclonal. El inmunocomplejo de alta carga negativa, migrará a la zona anódica de la albúmina.
Interpretación de Inmunotipificación (IT):
El principio del método es la sustracción, se busca la anomalía y se observa la desaparición de la misma. Cada curva patrón de referencia se observa superpuesta a las distintas curvas correspondientes de cada antisuero.
Existen reglas para poder interpretar las sustracciones de naturaleza policlonal de las monoclonales para cada antisuero. (Tabla 1)
En ausencia de sustracción de cadena pesada, y solo de cadena liviana, corresponderá una proteína monoclonal o en su defecto a la cadena liviana con una IgD o IgE, que por esta técnica no podemos resolver.
Ante la posibilidad de interpretar una polimerización, se puede realizar tratamiento reductor de la muestra con agente despolimerizante (BME: beta-mercaptoetanol, o DTT: ditriotreitol), y realizar la corrida de inmunotipificación.
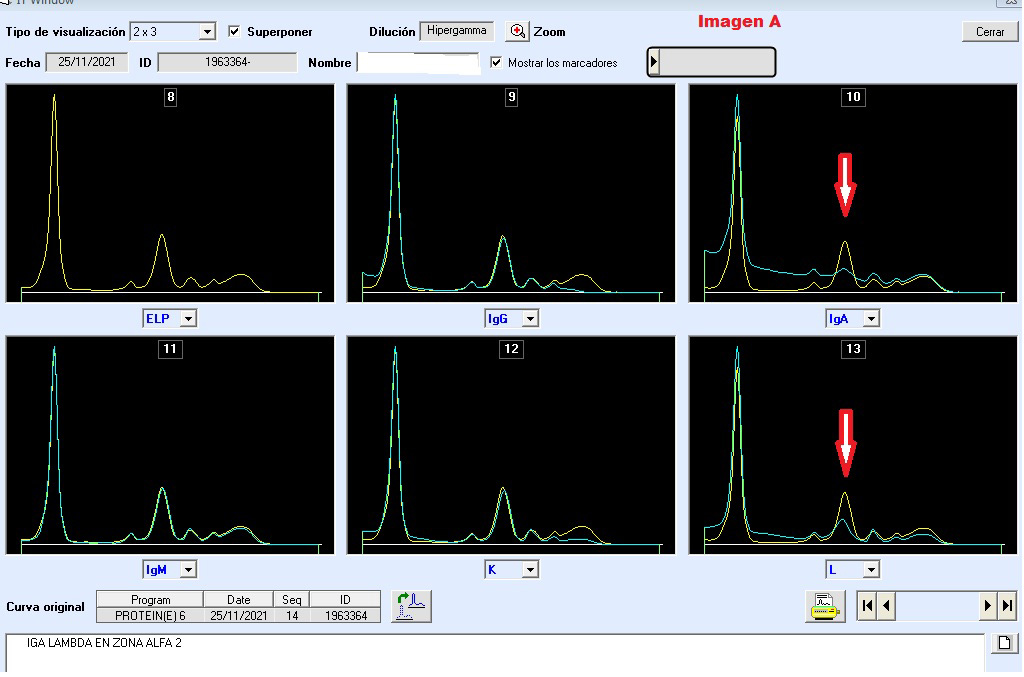
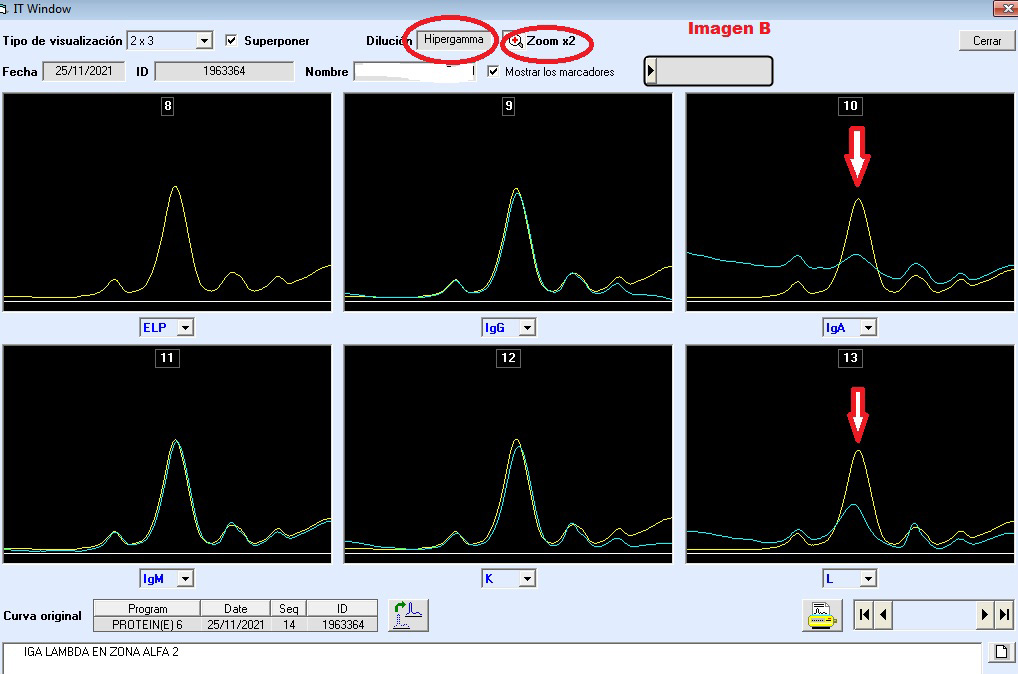
Una ventaja adicional es que el software permite magnificar la imagen a través de la herramienta de zoom, mejorando la sensibilidad de identificación de pequeñas sustracciones monoclonales, imágenes de interpretación de inmunotipificación en un caso de migración en zona de alfa 2 globulinas: (Fig. A y B).
Desempeño de la técnica de inmunotipificación (IT):
En cuanto al desempeño analítico a la hora del diagnóstico y seguimiento de gammapatías monoclonales, citamos el estudio reciente de Katie L.Thoren y Cols, donde se observó cómo impacta la capacitación de los analistas sobre la sensibilidad de la técnica de inmunotipificación. Los analistas no entrenados obtuvieron una sensibilidad promedio de 69%, aumentando a 88% luego de un entrenamiento dado por expertos en técnicas de inmunotipificación, lo que significó un aumento del 19% en la sensibilidad alcanzada para detección de proteínas monoclonalesz por IT. Comparado con los expertos que alcanzaron un 95% de sensibilidad. Demostraron además que la combinación de IT como IF con los ratios de dosificación de cadenas livianas libres como con la IF en orina, no existieron diferencias significativas en las sensibilidades si comparamos IT versus IF.
Este estudio demostró que la capacitación es fundamental para la interpretación precisa de la inmunotipificación, que la sensibilidad diagnosticada de la misma continúa mejorando con la experiencia. Además, no se encontró que las interpretaciones de las IT fueran más subjetivas o variables en comparación de la IF, incluso antes del entrenamiento 7. Otros autores han hecho eco a estos hallazgos sobre la sensibilidad comparable de la IT versus IF, años previos, Katzman y Cols, continuando con algunos más contemporáneos 9, 2.
“Este estudio demostró que la capacitación es fundamental para la interpretación precisa de la inmunotipificación”
Es conocido que los niveles de proteína monoclonal en la Amiloidosis son más bajos en comparación con el Mieloma Múltiple, haciendo más desafiante el diagnóstico. Miyazaki y Cols demostraron que la inmunotipificación es comparable a la inmunofijación en suero para identificar proteína monoclonal en esta situación clínica, y una mejor sensibilidad en los nuevos diagnósticos de Amiloidosis (Sensibilidad IT 41% versus 30% IF), siendo similares para pacientes en tratamiento, como cuando se combinan con el ratio de cadenas livianas libres. Remarcando nuevamente que estos resultados son reflejo del entrenamiento y la experiencia del analista 8.
Conclusión:
De acuerdo a mi experiencia cercana a una década en validación PEF en plataformas de EC/IT, puedo decir que me resulta una técnica que se adapta a los tiempos de hoy, en el cual el volumen de demanda es cada vez mayor, la automatización permite un flujo de trabajo al Turnaround Time (TAT) requerido, que cumple totalmente con las expectativas en cuanto al desempeño analítico a la hora del diagnóstico y seguimiento de proteínas monoclonales, estando a la par de la inmunofijación en los algoritmos de barrido para diagnóstico y seguimiento de gammapatías monoclonales, relegando en pocas situaciones, donde debemos realizar prueba réflex a IF para descartar presencia de la proteína monoclonal sin ser objetivable por IT (por ejemplo: hipogammaglobulinemias).
Aprender a trabajar con las reglas básicas de inmunotipificación es el primer paso de confianza, adquirir destrezas con la experiencia hace tener un ojo entrenado. Realizar la interpretación desde la plataforma utilizando la herramienta de zoom, es una acción obligada, ya que las trazas sustraídas pueden contener información importante, consiguiendo revelar la presencia de una proteína monoclonal no objetivable en el proteinograma electroforético, sobre todo en las zonas de difícil interpretación (zona beta 1, beta 2 globulinas y alfa 2 globulinas).
Considerar los diferentes ensayos que están al alcance, combinarlos estratégicamente y así mejorar la sensibilidad analítica es el objetivo. Cada laboratorio debe generar un algoritmo escalonado del uso optimizado de ensayos, que permita hacer posible la mayoría de los diagnósticos, y hacer la diferencia en la etapa asintomática de las gammapatías monoclonales que impacta directamente en la sobrevida del paciente al hacer diagnóstico oportuno
Referencias
1. Joannes F.M. Jacobsa, Katherine A. Turnera, Maria Stella Graziani, Jody L. Frinack,. (2020). An international multi-center serum protein electrophoresis accuracy and M-protein isotyping study. Part II: limit of detection and follow-up of patients with small M-proteins. Clin Chem Lab Med, 58(4), 547–559. doi:https://doi.org/10.1515/cclm-2019-1105
2. Massimo Pieri, F. T. (2020). Our Laboratory Experience: Comparison of Capillary Electrophoresis/Immunosubtraction and Agarose Gel/Immunofixation. Technium , 2(7), 267-277.
3. David F. Keren, MD; Gregary Bocsi, DO, MS; Brooke L. Billman, MLIS, AHIP; Joan Etzell, MD; James D. Faix, MD;. ( 2021). Laboratory Detection and Initial Diagnosis of Monoclonal Gammopathies: Guideline From the College of American Pathologists in Collaboration With the American Association for Clinical Chemistry and the American Society for Clinical Pathology. Arch Pathol Lab Med. doi:https://doi.org/10.5858/arpa.2020-0794-CP
4. Ronald A. Bootha, Christopher R. McCuddena, Cynthia M. Balionb, Ivan M. Blasutigc,. (2017). Candidate recommendations for protein electrophoresis reporting from the Canadian Society of Clinical Chemists Monoclonal Gammopathy Working. Clinical Biochemistry . doi:https://doi.org/10.1016/j.clinbiochem.2017.10.013
5. Jillian Tate, Grahame Caldwell, James Daly, David Gillis, Margaret Jenkins,Sue Jovanovich, Helen Martin, Richard Steele, Louise Wienholt and Peter Mollee. (2012). Recommendations for standardized reporting of protein electrophoresis in Australia and New Zealand. Ann Clin Biochem, 49, 242–256. doi:10.1258/acb.2011.011158
6. Shaji Kumar, Bruno Paiva, Kenneth C Anderson, Brian Durie, Ola Landgren, Philippe Moreau, Nikhil Munshi, Sagar Lonial, Joan Bladé,Maria-Victoria Mateos, Meletios Dimopoulos, Efstathios Kastritis, Mario Boccadoro, Robert Orlowski, et al. (2016). International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. Lancet Oncol , 17, 328–346. doi:https://doi.org/10.1016/S1470-2045(16)30206-6
7. Katie L. Thoren, S. I. (November de 2021). Immunotyping Provides Equivalent Results to Immunofixation in a Population with a High Prevalence of Monoclonal Gammopathies. The Journal of Applied Laboratory Medicine., 6( 6), 1551-1560. doi:10.1093/jalm/jfab067
8. Kanji Miyazaki & Kenshi Suzuki. (octubre de 2016). Capillary electrophoresis/immunosubtraction as a better alternative to immunofixation for detecting and immunotyping serum monoclonal proteins in patients with immunoglobulin light chain (AL) amyloidosis. Amyloid The Journal of Protein Folding Disorders, Early Online: 1–4. doi:10.1080/13506129.2016.1232647
9. Jerry A. Katzmann, Raynell Clark, Elizabeth Sanders, James P. Landers and Robert A. Kyle. (octubre de 1998). Prospective Study of Serum Protein Capillary Zone Prospective Study of Serum Protein Capillary Zone by Immunosubtraction. American Journal of Clinical Pathology, 110(4), 503-509. doi:10.1093/ajcp/110.4.503