Informe de un caso en paciente con Angioedema hereditario y síndrome de Samter tratado con anticoagulante de acción directa anti Xa (Rivaroxabán), secundario a angioplastía por cardiopatía isquémica
Responsable del Área de Coagulación - Instituto Nacional de Enfermedades Respiratorias, México
Introducción
El angioedema hereditario (AEH) es una enfermedad rara (su prevalencia estimada es de 1:50,000), de origen genético, que se transmite de forma autosómica dominante, si bien el 25 % de los casos resultan de una mutación de novo. Existen tres tipos básicos de AEH, el tipo 1 es el más frecuente (85 %) y se debe a un déficit de proteína C1 inhibidor (prot-C1-inh), mientras que el tipo 2 es debido a un déficit funcional de la prot-C1-inh con niveles normales o incluso elevados de la misma. La alteración en la prot-C1-inh altera la regulación de la cascada clásica del complemento en la coagulación y la liberación de bradicinina, lo que podría explicar parcialmente la clínica del cuadro 1. Recientemente se ha descrito un tipo 3, dependiente de estrógenos y con niveles de prot-C1-inh normales 2.
Mientras tanto la enfermedad respiratoria exacerbada por aspirina (EREA) o síndrome de Samter es una entidad crónica que comúnmente se caracteriza por la triada: asma bronquial, rinosinusitis crónica (RSC) con pólipos nasales y reacción de hipersensibilidad de la vía aérea a la aspirina, así como a otros inhibidores no selectivos de la enzima ciclooxigenasa (COX). Se encuentra dentro del amplio espectro de reacciones de hipersensibilidad inducida por los antiinflamatorios no esteroideos (AINES); es una entidad que debe ser reconocida ya que muchos pacientes con asma pueden tener otros factores de riesgo para eventos trombóticos, complicando el uso de antiagregación3. Fue definida por primera vez por Widal en 1942 y más tarde en 1968 es reconocida como la triada de Samter, después de que Samter y Beer describieron un grupo de pacientes con los síntomas referidos 3. La prevalencia de la hipersensibilidad al ácido acetilsalicílico se informa entre el 0.6% y el 2.5% de la población general, por otro lado, en grandes estudios basados en población de pacientes con la triada de Samter, el 30% a 40% desarrollan sensibilidad al ácido acetilsalicílico. Es un síndrome complejo que consiste en la inflamación crónica de la mucosa respiratoria en el que los pacientes experimentan los síntomas que lo caracterizan 3,4,5,6.
En pacientes con AEH y que presenten la triada de Samter; forman parte del amplio espectro de reacciones de hipersensibilidad inducida por los antiinflamatorios no esteroideos (AINE) que dificultan el diagnóstico, tratamiento y seguimiento, debido a las complicaciones que pueden presentar este grupo de pacientes con AEH. Entre las manifestaciones clínicas más frecuentes destacan: urticaria-angioedema exacerbada o inducida por múltiples AINE, anafilaxia inducida por un único AINE o reacciones tardías secundaria a AINE7,8.
En la literatura, son pocas las guías de manejo, algoritmos y pruebas de laboratorio que se recomiendan para el protocolo de atención de pacientes con EREA o síndrome de Samter, además como lo reporta Calderón y colaboradores, hay un desconocimiento de la enfermedad aún en el ámbito médico 9.
Con la revisión de este caso clínico se permite enfocar una búsqueda actualizada de la literatura para tener una aproximación sencilla y práctica de la enfermedad así como el enfoque y apoyo de las pruebas de laboratorio para un buen seguimiento; ya que se reporta que los pacientes con EREA tienen una mayor morbilidad, caracterizada por más asistencias de urgencia al hospital, en comparación con pacientes asmáticos no alérgicos a la aspirina, así que la identificación de este síndrome es crítica por las exacerbaciones del asma secundarias a la sensibilidad a la aspirina además de su morbilidad significativa y que pueden ser costosas 10.
Presentación del caso clínico
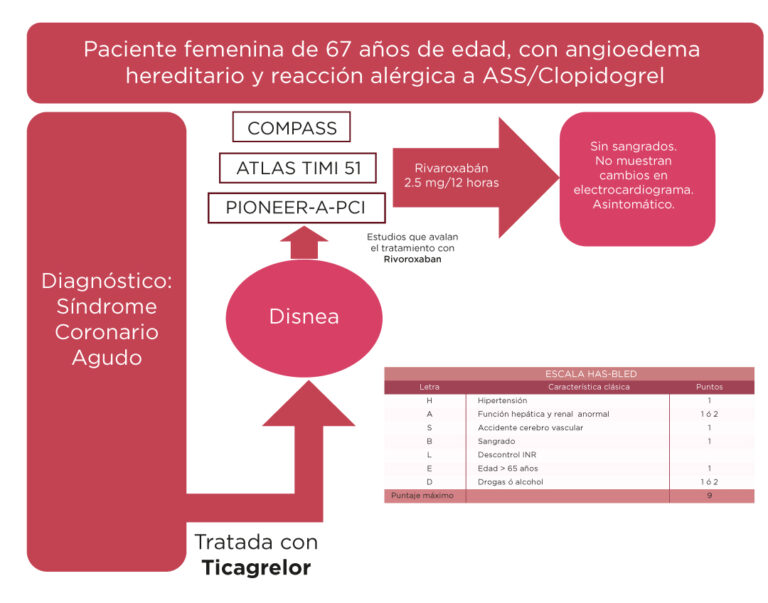
Se presenta un caso clínico de paciente del sexo femenino de 67 años de edad con AEH por deficiencia del inhibidor C1-INH del complemento y SxS presentando alergia a la aspirina. En 2006 manifiesta complicaciones y se medica con nadroparina 2850 UI/24 horas. Cardiopatía isquémica de 3 años de evolución, se somete a cateterismo con presencia de lesión en coronaria derecha con colocación de stent. Se trata con clopidogrel 75 mg manifestando reacciones adversas propias del angioedema, posteriormente con ticagrelor 90 mg/24 horas, presentando a la evolución: disnea de esfuerzo y alergias. Bajo estas circunstancias se decide prescribir rivaroxabán 2.5mg/24 horas (figura 1).
Resultados
La paciente tras 6 meses de tratamiento con rivaroxabán, se encuentra asintomática, no presenta dolor precordial, sin cambios electrocardiográficos de isquemia y sin manifestaciones cardiovasculares. Pruebas de laboratorio e imagen sin datos de alerta.
La paciente mencionada es obligada a terapia dual con aspirina y clopidogrel para evitar la trombosis intra stent, sin embargo, no es posible este manejo por el AEH y SxS, por lo que se decide prescribir rivaroxabán, a partir de los resultados del estudio COMPASS y ATLAS ACS 2-TIMI 51. El rivaroxabán está indicado en la prevención de acontecimientos aterotrombóticos en pacientes adultos tras un síndrome coronario agudo.
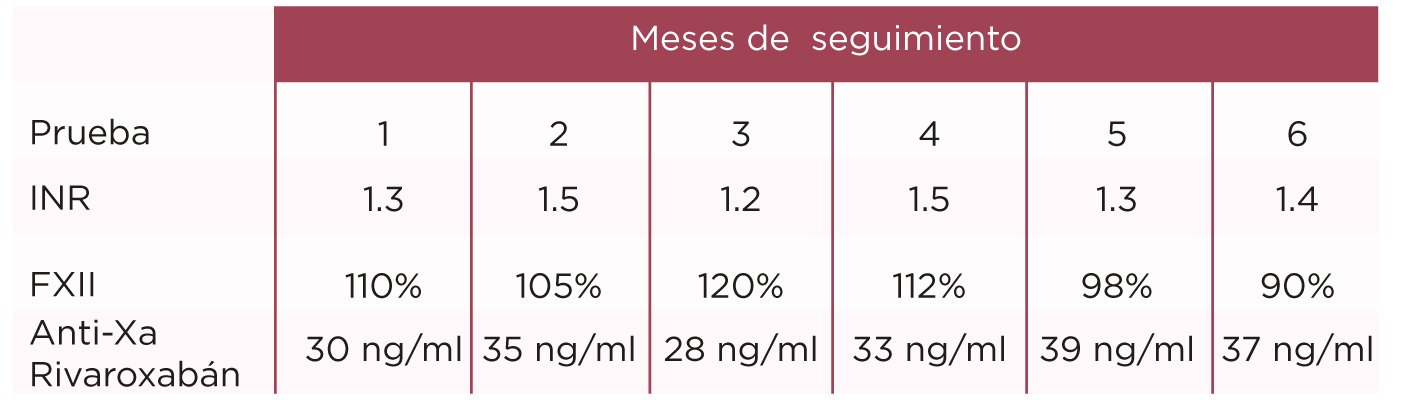
De las pruebas de seguimiento de laboratorio se realizaron los parámetros descritos en la tabla 1. Evaluando de manera global las pruebas de coagulación, así como la determinación de la actividad de FXII y anti Xa (rivaroxabán); por viscosimetría con reactivos e instrumentos de la marca STAGO.
Conclusión
La administración de rivaroxabán puede ser una alternativa de tratamiento segura para los pacientes con AEH y SxS que desarrollen cardiopatía, disminuyendo el riesgo de retrombosis intra-stent. Nuestra paciente con rivaroxabán ha evolucionado favorablemente durante los 6 meses de seguimiento.
En las pruebas de seguimiento de laboratorio, la actividad de factor XII, que es un causante de trombosis en este grupo de pacientes, se mantuvo en niveles dentro de lo normal conforme el tiempo y el tratamiento avanzaban. Así como los niveles de rivaroxabán en nuestra paciente demostraron clínicamente un riesgo menor para retrombosis en la paciente. Se evaluó el riesgo de sangrado con los valores bajos de INR durante los meses de seguimiento y vigilancia en nuestra paciente.
Referencias
1. Atkinson JP, Cicardi M, Zuraw B. Hereditary angioedema: Pathogenesis and diagnosis. UpToDate (base de datos en Internet). (Updated: Oct 20, 2014).
2. Miranda AR, Ue AP, Sabbag DV, Furlani Wde J, Souza PK, Rotta O. Hereditary angioedema type III (estrogen-dependent) report of three cases and literature review. An Bras Dermatol. 2013;88(4):578-484.
3. Sakalar EG, Muluk NB, Kar M, Cingi C. Aspirin-exacerbated respiratory disease and current treatment modalities. Eur Arch Otorhinolaryngol. 2017;274(3):1292-1300. DOI: 10.1007/s00405-016-4273-1
4. Hedman J, Kaprio J, Poussa T, Nieminen MM. Prevalence of asthma, aspirina intolerance, nasal polyposis.
5. Lee RU, Stevenson DD. Aspirin-exacerbated respiratory disease: evaluation and management. Allergy Asthma Inmmunol Res. 2011; 3 (1): 3-10.
6. Hernández MKE, Cardona R. Enfermedad respiratoria exacerbada por aspirina. Revisión a partir de casos clínicos. Rev Alerg Mex. 2017; 65 (1): 78-91.
7. Buchheit MK, Laidlaw MT. Update on the management of aspirin-exacerbated respiratory disease. Allergy Asthma Inmmunol Res. 2016; 8 (4): 298-304.
8. Laidlaw TM, Cahill KN. Current knowledge and management of hypersensitivity to aspirin and NSAIDs. J Allergy Clin Immunol Pract. 2017; 5 (3): 537-545.
9. Calderón JC, Dávila F, Mantilla R, Chérrez A, Calero E, Cabrera D et al. Knowledge and attitudes about aspirin exacerbated respiratory disease among Ecuadorian physicians. Rev Alerg Mex. 2017; 64 (1): 13-23.
10. Rajan JP, Wineinger NE, Stevenson DD, White AA. Prevalence of aspirin-exacerbated respiratory disease among asthmatic patients: a meta-analysis of the literature. J Allergy Clin Immunol. 2015; 135 (3): 676-681.